- 首頁
- 我們的服務
-
項目簡介
醫療器械檢測是確保產品安全、有效與合規的關鍵環節,涵蓋性能驗證、材料安全及生物相容性測試,旨在預防潛在風險,保護患者健康,推動行業持續發展。
服務項目
醫用敷料類、醫用輸注器具及醫用導管類、藥械組合醫療器械、醫美產品
服務優勢
資質完備:已獲得國家CMA、省級CMA及CNAS資質,檢測結果權威可靠。
項目全面:提供理化/微生物檢測、生物相容性研究(依據GB/T 16886/ISO 10993)及臨床前功能性評價的一站式服務。
專業團隊:擁有經驗豐富的檢測隊伍,精通各類醫療器械標準與流程,確保高效精準服務。
風險控制:通過體外/體內實驗綜合評價產品安全性,助力產品合規上市,提升市場競爭力。
-
服務簡介
華微檢測是由廣州高新區投資集團直屬單位聯合華南新藥創制中心及海歸技術團隊共同建設的第三方檢測機構,專注生物安全、生物醫藥與動物實驗等領域。我們搭建生物制品分析檢測綜合平臺,嚴格遵循ISO/IEC17025體系,已獲國家CMA和CNAS認證,提供符合《中國藥典》要求的細胞系/株全面檢定服務,適用于抗體、重組蛋白、疫苗、細胞基因治療產品等生物制品的合規報批。
服務項目
細胞庫檢測、生物制品批放行檢查/型式檢查、細胞內外源病毒因子檢查、原輔料/培養基/耗材檢查、工藝雜質殘留研究、微生態制劑(活菌制劑)檢查
服務優勢
權威資質:通過CMA、CNAS認證,實驗室符合GMP體系,檢測結果具法律效力和國際公信力。
高標準實驗室:配備多間加強型P2實驗室(廣州市備案),B+A環境,滿足無菌及病毒檢測要求。
法規符合性強:嚴格遵循FDA、CHP、EP、ICH等國際國內法規,建立全面細胞庫檢定流程。
專業團隊與技術:依托高水平技術團隊和完備操作規程,為客戶提供精準、高效的生物制品檢測服務。
-
服務簡介
我司提供全面的藥代藥效學研究評價服務。我們嚴格遵循NMPA、FDA和ICH相關技術指導原則,為客戶提供符合申報要求的全套體內外評價模型與試驗數據支持。
服務項目
藥代動力學研究、 藥效學研究、皮膚外用試劑透皮吸收研究
服務優勢
綜合平臺:整合藥代、藥效及透皮研究能力,提供從體外到體內的一體化評價方案。
專業團隊:擁有經驗豐富的研究人員,精通各類藥物劑型與模型的評價標準與法規要求。
先進設備:配備LC-MS/MS、高效滲透系統等先進儀器,保證數據精準、可靠。
合規高效:實驗過程嚴格遵循GLP規范,支持國內外注冊申報,加速產品研發與上市進程。
-
服務簡介
華微檢測提供專業的藥品及原輔料質量研究與檢測分析服務,配備精密儀器實驗室、核磁共振實驗室及多類先進分析設備,涵蓋理化性質分析、雜質研究、含量測定及方法開發與驗證等項目,全面支持藥品研發、生產及注冊申報的質量控制需求。
服務項目
藥品/原輔料理化檢查、藥品微生物檢查、效價與生物學活性、生物安全性檢測(生物制品)、抗菌/抗病毒藥物篩選
服務優勢
設備先進齊全:配置HPLC、LC-MS、GC-MS、ICP-MS、AAS、酶標儀等多類型高端儀器,保證檢測數據精準可靠。
技術能力深厚:具備藥品及原輔料方法開發與驗證經驗,可提供從常規檢測到復雜研究的全流程解決方案。
定制化服務:依據企業實際需求,提供靈活、高效的定制化開發與檢測服務,助力企業加速研發進程。
平臺資源豐富:依托完備的實驗室平臺和專業團隊,能夠同時應對多品類、多標準的藥品質量評價任務
-
服務簡介
新型冠狀病毒疫情嚴重危害人類健康,已成為全球關注的公共衛生問題。抗病毒材料作為一種重要的防護手段,可有效抑制和殺滅病毒,但其實際效果需通過專業檢測驗證。 隨著疫情防控常態化,市場對消毒及健康防護產品的需求持續增長,相關企業對于產品檢測的需求也日益迫切。 華微檢測為企業提供抗病毒材料及病毒消殺產品的專業檢測服務,助力產品有效性驗證,為公共健康保駕護航。
服務項目
凈化產品病毒去除性能測試、消毒產品病毒滅活效果測試、日化輕工材料抗病毒效果測試、精品定制化服務
服務優勢
精英團隊,背景多元:技術團隊由廣微所、華南新藥創制中心、高校重點實驗室人員及病毒學領域海歸博士專家組成,結構合理、實戰經驗豐富。
頂尖設備,科研級服務:依托先進硬件設施與高層次科研隊伍,在常規檢測中提供深度、沉浸式的科研體驗。
靈活定制,一站式支持:除標準化測試外,支持各類客供實驗方案,為產品開發與課題研究提供精品化、全方位技術服務。
-
服務簡介
食品保健品檢測是通過理化、微生物與毒理學等方法,對食品及保健品的成分、安全性、功效及標簽合規性進行全面分析的科學過程。 我們致力于通過檢測重金屬、農殘、微生物等風險物質,保證產品安全;驗證有效成分與宣稱功能,確保功效可信
服務項目
食品保健品毒理學檢測、食品保健品功效評價研究、其它定制化服務
服務優勢
符合國家標準與國際法規,助力市場準入; 具第三方檢測報告,增強消費者信任,提升產品競爭力。
-
華微檢測除核心檢測服務外,還可提供以下延伸技術支持:專業實驗空間租賃、定制化實驗方案設計、規范化的實驗動物代養 實驗方案設計是決定科研成敗與數據可靠性的關鍵環節。我們憑借專業團隊和豐富經驗,協助客戶根據研究目標與條件,設計科學、嚴謹、可操作的實驗方案,為項目順利開展提供堅實基礎。
- 新聞資訊
- 檢測流程
- 下載中心
- 關于我們
- 聯系我們
 藥械組合醫療器械檢測華微檢測專注藥械組合醫療器械檢測,提供藥物化學和物理性能檢測,生物相容性研究(細胞毒性/致敏/植入試驗等,符合GB/T16886系列標準),藥代動力學/藥效學研究,覆蓋藥物殘留,局部安全性,系統毒性評價。
藥械組合醫療器械檢測華微檢測專注藥械組合醫療器械檢測,提供藥物化學和物理性能檢測,生物相容性研究(細胞毒性/致敏/植入試驗等,符合GB/T16886系列標準),藥代動力學/藥效學研究,覆蓋藥物殘留,局部安全性,系統毒性評價。藥械組合醫療器械檢測
藥械組合產品是指由藥品與醫療器械共同組成,并作為一個單一實體生產的醫療產品,其中以醫療器械作用為主的藥械組合產品按照醫療器械管理,簡稱藥械組合醫療器械。針對這類產品,需特別關注藥物和醫療器械與藥物相互作用等引入的潛在風險,華微檢測具備專業的藥物分析、醫療器械生物學評價及藥代動力學研究人員,可為客戶提供全方位的檢測服務,以確保藥械組合醫療器械的安全性和有效性。
一、藥物化學和物理性能檢測
服務項目:藥物單體或溶劑殘留、添加劑、添加劑/助劑/催化劑/交聯劑等殘留、生物學活性、純度、雜質、微粒、藥劑量/物定性定量檢測及方法學驗證等。
分析技術:HPLC、GC、HPLC-MS/MS、LC-MS/MS、ICP-MS、ELISA法等
二、生物相容性研究
生物相容性是指生物體組織對非活性材料產生反應的一種性能,一般是指材料與宿主之間的相容性,包括組織相容性和血液相容性。醫療器械生物相容性評價較基本的內容之一是生物安全性,主要為生物學評價,因此,醫療器械生物相容性評價關注的重點是,醫療器械在和人體之間的相互作用下,是否對人體無毒性、無致敏性、無刺激性、無致癌性對人體組織、血液、免疫等系統無不良反應。
涉及領域
檢測項目
檢測方法
檢測依據
生物相容性檢測
細胞毒性
MTT 法
GB/T 16886.5-2017/
ISO 10993-5:2009瓊脂擴散法
直接接觸法
浸提定性法
濾膜擴散法
刺激試驗
皮膚刺激
GB/T 16886.23-20237/
ISO 10993-23:2021皮內反應
眼刺激
口腔粘膜刺激
直腸刺激
陰莖刺激
陰道刺激
致敏試驗
GPMT豚鼠較大劑量試驗
GB/T 16886.10-2017/
ISO 10993-10:2010BT豚鼠封閉貼敷試驗
全身毒性試驗
急性全身毒性
GB/T16886.11-2021/
ISO10993-11:2017 5亞急性全身毒性
亞慢性全身毒性
慢性全身毒性
材料介導的致熱性
熱原試驗
GB/T16886.11-2021
《中國藥典》2020年版四部 通則 1142細菌內毒素試驗
GB/T 14233.2-2005 4
遺傳毒性試驗
細菌回復突變
GB/T 16886.3-2019
體外染色體畸變
小鼠淋巴瘤基因突變
骨髓微核試驗
YY/T 0870.4-2014
植入試驗
皮下
GB/T 16886.6-2022
肌肉
骨植入
腦植入
血液相容性
普通溶血試驗
GB/T 16886.4-2022
ASTM溶血試驗(直接或間接)
血小板和白細胞計數
植入后局部反應試驗
為了防止醫療器械在臨床使用時引起不良反應,醫療器械生產商需要根據相關的檢測標準進行生物相容性評估。
作為生物相容性測試的重要組成部分,植入后局部反應試驗是生物學評價試驗項目中較接近或模擬臨床應用狀況的一項試驗,且試驗中對動物選擇、植入部位、植入器械的材料組成及形狀大小、觀察與處死動物的時間等都因醫療器械產品實際接觸人體的部位以及在體內持續時間的長短而異。
植入后局部反應試驗通過對動物局部組織內植入醫療器械產品的代表性部分來評價其植入一定周期后對局部活組織的潛在反應,這種評價是運用組織病理技術評價植入部位的細胞反應及組織反應。根據植入部位的不同可將植入后局部反應試驗劃分為:肌肉植入試驗、皮下植入試驗、骨植入試驗及腦植入試驗等。
植入樣品的制備
通常來講,臨床上使用的醫療器械因其尺寸太大或其它物理化學等方面原因,不宜直接植入供試動物的特定組織內。應按照臨床應用中器械的暴露比例制備合適尺寸的植入小樣并根據較終產品預期所用方法對每個植入樣品進行加工、處理、清洗污染物和滅菌。
因物理特性(例如形態、密度、硬度、表面)可能影響試驗材料組織反應,因此對照品的選擇和/或制備也同樣應該引起重視。對照材料應與試驗樣品具有盡可能相近的物理或化學特性,如多孔器械、可降解材料等常會引起一定的組織、細胞反應,選擇同類型的對照材料可降低較終評分,同時也是比較合適的。常用的且經濟易獲得的陰性對照材料有聚乙烯(PE)、聚丙烯(PP)、聚四氟乙烯(PTFE)、或高密度聚乙烯(HDPE)等。
植入周期的選擇
根據臨床接觸時間或材料預期引起生物學反應的時間來確定試驗周期。
非吸收性材料,根據臨床接觸時間,短期可選擇評估植入后1周和4周的局部反應,長期可選擇評估植入后13周和/或26周的局部反應。
可吸收性/可降解材料一般考慮涵蓋三個時間點,分別是:無降解或降解初期、降解中間期(降解速率較快,降解程度一半)、當植入材料完全吸收或處于穩定狀態。必要時可以再增加一個長期時間點。
植入部位選擇及注意事項
肌肉植入:臨床上植入肌肉組織或近似組織,或其它非皮下組織、骨或腦組織的醫療器械,一般外部接入的間接或直接接觸血液的器械也可考慮選擇肌肉植入。手術創傷帶來的影響在肌肉植入評價中顯得尤為突出。植入材料的局部生物學反應與材料特性和手術創傷反應有關,術后植入物周圍組織結構的改變隨時間而變化。植入后的較初2周,可能很難將外科手術所致的反應與植入物引起的組織反應區分開來。在肌肉中,植入9周至12周時細胞群呈穩定狀態,這取決于動物種屬和手術創傷的嚴重程度。
皮下植入:臨床上植入皮下組織或近似組織。用鈍性分離器在皮下位置分離出放置植入物的囊袋,避免各植入物游離重疊,如果植入物為片狀,避免片狀物折疊。
骨植入:骨固定器械、骨修復材料等。根據動物種屬和植入大小,選擇植入脛骨或者股骨。
腦植入:腦部植入電極、腦積水分流器、引流器等。供試品和對照品應使用等同的解剖學位點,每只動物應只植入一側大腦半球且只能植入供試品或者對照品。大鼠可植入1個位點,兔較多可植入2個位點。
檢測項目
檢測方法
檢測依據
植入試驗
皮下
GB/T 16886.6-2022、GB/T16886.11-2021/
ISO10993-11:2017 5肌肉
骨植入
腦植入
三、藥代動力學/藥效學研究
藥械組合醫療器械需重點關注藥物局部應用的安全性和有效性,藥代動力學研究是評價相關產品安全性和有效性的重要環節,當組合應用后藥物血藥濃度大于常規藥物使用的血藥濃度時,還需對系統毒性進行評價。
內容
研究參數
方法學研究內容
藥物體外釋放動力學研究
(擴散池法:貼劑、凝膠劑、膏劑類)
累積釋放量、釋放速率(μg/h)等
專屬性、準確度、精密度、檢測限、定量限、線性、范圍、耐用性等。
藥物體內非臨床藥代動力學研究
(小鼠、大鼠、犬、豬等)
吸收、分布、代謝、排泄及動力學參數
藥效學研究
藥械組合產品協同增效作用研究
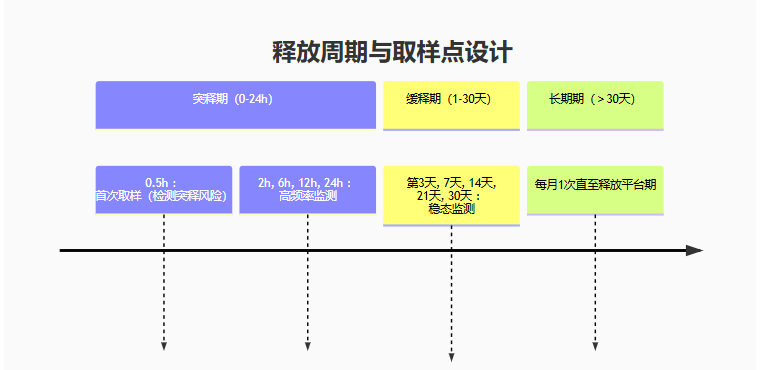
體內生物樣本分析檢測方法建立與驗證
非臨床藥代動力學研究
(小鼠、大鼠、比格犬、猴等)
血藥濃度-時間曲線(藥動學特征,線性特征,性別差異等)
在體吸收(體外細胞試驗、在體或離體腸道吸收試驗,絕/對生物利用度、相對生物利用度)
分布(全血血漿分配、血漿蛋白結合、血液紅細胞分布測定、組織分布)
排泄
臨床藥代動力學研究生物樣本藥物濃度分析檢測
人體生物等效性研究
人體藥代動力學研究
治療藥物監測
四、體內外藥效學
可通過體外試驗、動物試驗研究藥物作用機理、作用強度、治療作用及療效特定,以及結合藥物代謝特點的PD/PK試驗(研究體內藥物濃度與時間的關系、作用效應強度的關系的實驗),提供高效優質的體內外藥效學服務,支持后期的臨床試驗。
研究對象:
中藥、化學藥、生物技術藥品(包括基因治療產品、細胞治療產品等)
研究內容:
初步有效性試驗:探索對特定適應癥的治療作用及量效關系等。
主要藥物學研究:評價藥物對特定適應癥的治療作用及作用特點。
藥械組合醫療器械檢測華微檢測專注藥械組合醫療器械檢測,提供藥物化學和物理性能檢測,生物相容性研究(細胞毒性/致敏/植入試驗等,符合GB/T16886系列標準),藥代動力學/藥效學研究,覆蓋藥物殘留,局部安全性,系統毒性評價。為您推薦更多

掃碼添加史工 掃碼添加嚴工
聯系人:史工18928790749、嚴工
聯系電話:19924323595、020-82118202、020-31608627
地址:廣州市黃埔區攬月路3號F棟316(總部)廣州市黃埔區科學城尖塔山路1號(動物中心)
版權所有 ? 廣東省華微檢測股份有限公司国产精品111 | av噜噜噜 | 欲乱美女 | 国产精品第56页 | 日本成人在线网站 | 男人的天堂你懂的 | 欧美在线视频免费观看 | 又大又粗又爽18禁免费看 | 国产人妻黑人一区二区三区 | 三级自拍| 少妇无套内谢久久久久 | 日本精品视频在线 | 精品国产av无码 | 免费黄色大片网站 | 欧美久久一区二区 | 特黄大片又粗又大又暴 | 香蕉在线视频观看 | 黄色片片片 | 欧美三级一区 | 在线观看中文字幕第一页 | 91成人免费| 国产精品主播一区二区 | 国产少妇在线 | 黄色av免费网站 | 亚洲综合一区二区 | 欧美人体做爰大胆视频 | 99热网| 中文视频在线 | 台湾swag在线播放 | 爱爱爱网 | 精品久久影视 | 亚洲卡一卡二卡三 | 日本黄色www | 在线免费黄网 | 波多野结衣视频一区 | 日韩在线播放av | 色呦呦中文字幕 | 久久久男人的天堂 | 国产视频1区2区 | 激情影院内射美女 | 四虎影视永久地址 | 色在线免费观看 | 亚洲色图 美腿丝袜 | 日韩av手机在线播放 | 国产精品黄 | 日韩精品一区二区三区在线播放 | 国产日韩一区二区三免费高清 | 屁股夹体温计调教play | 日本大片在线观看 | 亚洲av色香蕉一区二区三区 | 私拍在线| 亚洲黄色免费网站 | 人妻洗澡被强公日日澡 | 中文在线中文资源 | 高潮毛片又色又爽免费 | 就操成人网 | 99在线免费 | 久久免费国产 | 欧美涩涩涩| 伊人影音 | 久久艹精品 | 国产精品欧美久久久久天天影视 | 亚洲成人午夜电影 | 成人av网站在线观看 | 国产亚洲精品熟女国产成人 | 欧美日韩小视频 | 国产成人亚洲综合a∨婷婷 日韩精品成人av | 人妖系列 | av基地网 | 国产精品视频一区在线观看 | 依人成人| 手机av网 | 亚洲黄色片在线观看 | 国产成人精品无码高潮 | 色啪网| 免费一区二区三区四区 | 极品美女一区二区三区 | 四虎亚洲精品 | 日本午夜激情 | 天天干免费视频 | 手机免费在线观看av | 成人激情视频在线观看 | 性淫bbwbbwbbw| 天堂中文在线免费观看 | 男女无遮挡免费视频 | 国产一国产精品一级毛片 | 草莓在线 | 国产无遮挡aaa片爽爽 | 亚洲无码久久久久 | 国产激情免费 | 国产午夜福利一区二区 | 亚洲视频精品 | 日本免费黄色片 | 窝窝午夜理论片影院 | 视频在线观看网站免费 | 伊人久久一区二区 | 亚洲欧美精品一区二区 | 性孕妇free特大另类 | 成人高清在线观看 | 综合网久久 | www.狠狠撸.com| 久久艹影院 | 影音先锋国产资源 | 中国黄色一级视频 | 欧美一二 | 久久久久亚洲av成人片 | 欧美z○zo重口另类黄 | 精品在线一区二区 | av三级在线观看 | 午夜精品福利在线 | 91久久精品国产91久久 | 国产免费av在线 | 日韩欧美精品 | 国产精品综合网 | 国产熟女高潮一区二区三区 | 国产亚洲精品久久久久久无几年桃 | 国产微拍一区 | 国模无码国产精品视频 | 91麻豆精品久久久久蜜臀 | 日韩大胆人体 | 男人和女人免费观看电视连续剧 | 99只有精品 | 污黄视频在线观看 | 伊人久久五月 | 成人18视频在线观看 | 欧美日韩在线视频观看 | 奇米影视首页 | 97免费超碰 | 久久午夜夜伦鲁鲁片 | 国产天堂网 | 毛片毛片毛片毛片毛片毛片毛片 | 看看黄色片 | 国产精品99久久久久久www | 97国产精品 | 成人av动漫在线观看 | 蜜臀av无码精品人妻色欲 | 人人人人你人人人人 | 香蕉911| 日韩av电影网站 | 国产尤物在线视频 | 麻豆视频在线免费观看 | av天天干| 特黄特色免费视频 | 成人美女免费网站视频 | 日韩一级特黄 | 伊人色播 | 亚洲日本黄色 | 无人在线观看高清视频 | 天天操天天舔天天干 | 婷婷综合五月 | 69日本xxxxxxxxx59 国产精品欧美一区二区三区 | 亚洲天堂少妇 | 青青草中文字幕 | 日韩av一二三区 | 男人狂揉女人下部视频 | a免费在线观看 | 日本一区二区在线 | 成人性生交大片免费卡看 | 日韩精品三级 | 色婷婷一区二区 | 久久久精品人妻无码专区 | 欧美日韩视频一区二区三区 | 色哟哟在线观看视频 | 一级性生活毛片 | 亚洲精品视频一区二区 | 中文字幕精品在线 | 久久精品夜色噜噜亚洲a∨ 女王人厕视频2ⅴk 日韩欧美在线视频免费观看 | ass日本寡妇pics | 色av网站 | 中文字幕亚洲无线码在线一区 | 伊人伦理 | 精品国产乱码久久久久久婷婷 | 久久久精品一区二区 | 村姑电影在线播放免费观看 | 日日操夜夜干 | 天天操婷婷 | 亚洲免费三区 | 永久免费成人代码 | 四虎午夜| 亚洲成网站 | 午夜91视频 | 女优一区 | 美国大片在线观看 | 在线网站你懂得 | 亚洲 精品 综合 精品 自拍 | 日韩午夜小视频 | 91麻豆精品一区二区三区 | 亚洲综合图 | 女同av网站 | 91精品国产成人观看 | 337p粉嫩大胆色噜噜噜 | 日本一区二区三区在线免费观看 | 韩国伦理片在线播放 | 丁香六月色婷婷 | 国产一级伦理片 | 欧美少妇xxx| 男人与雌性宠物交啪啪 | 久久人人爽人人爽人人片av免费 | 免费高清欧美大片在线观看 | 91精品国产乱码久久久久久久久 | 日韩乱码在线观看 | 他揉捏她两乳不停呻吟动态图 | 毛茸茸日本熟妇高潮 | 激情综合色 | 成年人性生活视频 | 亚洲精品乱码久久久久久蜜桃欧美 | 国产伦一区二区三区 | 成年人av在线 | 九九在线观看视频 | 艳妇臀荡乳欲伦交换在线播放 | 亚洲欧美激情另类校园 | 精品国产av色一区二区深夜久久 | 青青操国产 | 三级视频网 | 免费黄av| 日本中文字幕电影 | 意大利少妇愉情理伦片 | 北条麻妃一区二区三区免费 | 欧美在线性爱视频 | aaaaa毛片| 成人h片 | 欧美一区二区三区免费 | 欧美福利片在线观看 | 中文av字幕 | 国产精品九九九九九 | 亚洲高清免费观看高清完整版在线观看 | 中国av免费| 国产无限资源 | 人人澡人人澡人人 | 熟妇的味道hd中文字幕 | 一级免费大片 | av动漫网 | 欧美一区在线看 | 成人依依 | 中文字幕一区二区人妻 | 午夜视频入口 | 国产麻豆剧果冻传媒白晶晶 | 成人va视频 | 日韩毛片在线看 | 可以免费看av的网站 | 深夜视频在线 | 三级电影中文字幕 | 美国特色黄a大片 | 一级黄色录象 | 欧美第二区 | 国产成人在线一区 | 国产精品美女一区二区三区 | 在线视频免费播放 | 久久这里只有精品9 | 在线五月天 | 毛片视频播放 | 成人小视频在线播放 | 嫩草影院懂你的影院 | 99青草 | 成人日韩在线 | 男男啪啪网站 | 日韩福利电影在线观看 | 在线免费中文字幕 | 久久精品| 91玉足脚交白嫩脚丫 | 最新黄网 | 国产伦精品一区二区免费 | 亚洲国产一二三区 | 国产污污视频 | 欧美成人精品一区二区免费看片 | 亚洲国产精品免费 | 日本最新中文字幕 | 国产精品99久久久久久久 | 巨物撞击尤物少妇呻吟 | 男男做性免费视频网 | 夫妻黄色片 | 五月综合色 | 长河落日电视连续剧免费观看01 | 欧美精品自拍偷拍 | 中文字幕精品一区 | 三级黄色在线视频 | 亚洲爽爽 | 中国三级黄色 | 男同互操gay射视频在线看 | 波多野结衣人妻 | 蜜桃av乱码一区二区三区 | 丁香花国语版普通话 | 国产精品扒开腿做爽爽 | 国产人妻一区二区 | 天堂网av2018 | 又黄又爽的视频 | 性高潮视频在线观看 | 免费福利视频在线观看 | 三级男人添奶爽爽爽视频 | 亚洲精品一区中文字幕乱码 | a在线免费观看 | 日韩123 | 九九热最新视频 | 精品无码人妻少妇久久久久久 | 国产黄色录像 | 亚洲精品视 | 一级国产黄色片 | 18成人在线观看 | 色婷婷av一区二区 | 奇米一区二区三区 | 欧美精品 在线观看 | 激情深爱| 手机看片亚洲 | 成人性生交大片免费卡看 | 韩国禁欲系高级感电影 | 免费av地址 | 超级碰碰97 | 日日人人| 久久久久无码国产精品一区李宗瑞 | 亚洲av永久纯肉无码精品动漫 | 琪琪五月天 | 在线观看中文字幕第一页 | 成人在线电影网站 | 欧美高清在线视频 | 欧美绿帽交换xxx | 朝桐光一区二区三区 | 免费黄色网址大全 | 99国产精品一区二区 | 久久国产高清 | 秋霞福利 | 操女人逼逼视频 | 一区二区三区在线免费观看 | 日韩精品电影一区 | 永久免费看片在线观看 | 国产成人久久 | 亚洲国产精品激情在线观看 | 午夜精品久久久久久久第一页按摩 | 操碰在线观看 | 亚洲AV无码阿娇国产精品 | 免费观看在线观看 | 亚洲国产日韩av | 国产网红在线观看 | 午夜888| 免费观看全黄做爰的视频 | 免费看日韩av| 午夜精品电影 | 国产人妻人伦精品1国产丝袜 | 中文字幕高清在线观看 | 免费操人视频 | 精品一区二区三区中文字幕 |- 生物制品服務工作站
- 特色檢測服務
- 醫療器械檢測
- 生物制品檢測
- 非臨床研究與生物樣本檢測
- 藥品檢測
- 病毒殺滅檢測
- 食品/保健食品檢測
- 其他檢測服務
-




 立即咨詢
立即咨詢 留言咨詢
留言咨詢





